同素异形体(同素异形体之间的转化属于)
常见的同素异形体
1、常见的同素异形体包括: 金刚石与石墨 C60(富勒烯) 氧气与臭氧 红磷与白磷 正交硫与单斜硫 在日常生活中,我们常见的同素异形体有: 碳的同素异形体:金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔。 磷的同素异形体:白磷和红磷。
2、常见的同素异形体有:金刚石,石墨,C60;氧气,臭氧;红磷,白磷;正交硫,单斜硫。生活中最常见的,有碳的同素异形体:金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔;磷的同素异形体:白磷和红磷;氧的同素异形体:氧气、臭氧、四聚氧和红氧。
3、碳的同素异形体包括金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔。 磷的同素异形体主要有白磷和红磷。 氧的同素异形体包括氧气、臭氧、四聚氧和红氧。同素异形体是由相同元素组成,但结构不同的单质。它们在物理性质上存在显著差异,化学性质上也各有特点。
4、中学阶段常见的同素异形体包括: 金刚石与石墨:这两种物质都是由碳元素构成,但它们的结构不同。金刚石由每个碳原子与四个其他碳原子形成的四面体网络结构组成,而石墨则是由层层平行排列的六边形碳原子网络构成,层与层之间的相互作用较弱。 氧气与臭氧:氧气和臭氧都是氧元素的不同形态。
5、初中阶段常见的同素异形体有:金刚石、石墨、C60 :由碳元素组成的不同单质,其化学性质相似。氧气、臭氧:氧气为O2,臭氧为O3,氧气无色无味,臭氧为淡蓝色有鱼腥味。红磷、白磷:红磷是红色的,白磷是黄色的。正交硫、单斜硫:正交硫是黄色的,单斜硫是淡黄色的。
6、同素异形体是由相同元素组成,但具有不同性质的单质形态。 常见例子包括碳元素形成的石墨、金刚石和C-60(富勒烯)以及磷元素的白磷和红磷。 氧元素的同素异形体有臭氧和氧气。 同素异形体的区别主要体现在物理性质上,化学性质上也有所不同。
同素异形体有哪些
1、金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔是碳的同素异形体。 白磷和红磷是磷的同素异形体。 氧气、臭氧、四聚氧和红氧是氧的同素异形体。 同素异形体是由相同元素组成,但具有不同形态的单质。尽管它们的化学性质相似,但物理性质存在差异。
2、碳的同素异形体包括金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔。 磷的同素异形体主要有白磷和红磷。 氧的同素异形体包括氧气、臭氧、四聚氧和红氧。 同素异形体是由相同元素组成,因排列方式不同而具有不同性质的单质。
3、碳、石墨、金刚石 都是由同一种元素——碳组成的不同单质,因此它们互为同素异形体。石墨和金刚石的结构不同,导致它们的物理性质有很大差异。石墨具有层状结构,而金刚石具有立体网状结构。 氧气、臭氧 都是由氧元素组成的不同单质,因此它们互为同素异形体。
4、碳元素形成了多种同素异形体,包括金刚石、石墨、富勒烯、碳纳米管、石墨烯以及石墨炔。 磷元素的同素异形体有白磷和红磷,两者在物理性质和化学性质上都有显著差异。 氧元素的同素异形体包括氧气、臭氧、四聚氧和红氧,它们的存在形式虽然不同,但都是由氧原子构成。
5、碳的同素异形体包括金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔。 磷的同素异形体有白磷和红磷。 氧的同素异形体包括氧气、臭氧、四聚氧和红氧。同素异形体是由相同元素组成,但结构不同的单质,因此它们在物理性质上有显著差异,化学性质上也存在活性差异。
6、金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔等都是由纯碳构成,但排列方式不同,因此它们是碳的同素异形体。 磷元素存在两种同素异形体:白磷和红磷。它们具有不同的物理性质,例如着火点:红磷约为240摄氏度,而白磷则只需40摄氏度。
同位素和同素异形体有什么区别和联系?
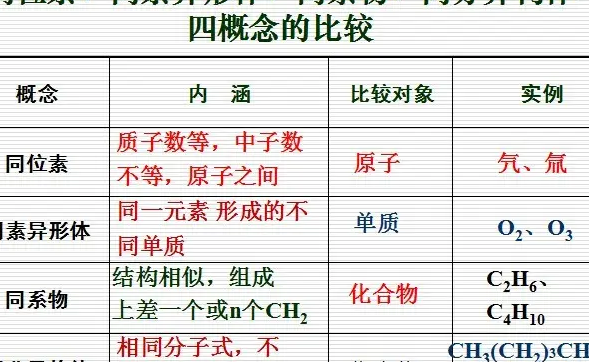
性质不同 同位素指的是具有相同质子数但不同中子数的同一元素的不同核素,它们互为同位素。同素异形体是指由相同元素组成,但由于结构排列方式不同,而展现出不同性质的不同单质。
性质不同 具有相同质子数,不同中子数的同一元素的不同核素互为同位素(Isotope)。同素异形体是指由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质。
同素异形体指的是单质。同位素指的是元素。不同的地方 同位素是由同样的单一化学元素组成,因排列方式不同,而具有不同性质。同位素是具有相同质子数,但中子数不同的单质。理化性质 同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。
同位素和同素异形体的区别在于它们所涉及的原子结构和性质的不同。同位素和同素异形体是两个不同的概念:同位素:指的是具有相同原子序数(即相同的化学元素)但不同质量数的原子。也就是说,它们具有相同的原子核中的质子数,但中子数不同。
初中同素异形体有哪些
初中阶段常见的同素异形体有:金刚石、石墨、C60 :由碳元素组成的不同单质,其化学性质相似。氧气、臭氧:氧气为O2,臭氧为O3,氧气无色无味,臭氧为淡蓝色有鱼腥味。红磷、白磷:红磷是红色的,白磷是黄色的。正交硫、单斜硫:正交硫是黄色的,单斜硫是淡黄色的。
氧气与臭氧、石墨与金刚石、碳60、红磷与白磷、黑磷、灰锡与白锡、晶体硅与无定型硅,这些都是常见的同素异形体。同素异形体是由同种元素组成的不同单质,它们的结构和性质各不相同。在化学中,研究同素异形体有助于我们更深入地理解元素的多样性和物质的复杂性。
石墨和金刚石确实是同素异形体。它们都是由碳元素组成的不同单质,具有相同的化学性质,但由于结构不同,因此物理性质有所差异。石墨呈层状结构,而金刚石则具有正四面体空间网状结构。同样,氧气和臭氧也都是同素异形体。它们都是由氧元素组成的不同单质,分子式分别为O2和O3。
初中阶段,学生们通常会学习到金刚石和石墨、氧气和臭氧、红磷和白磷等例子,这些都是同素异形体。同素异形体指的是由同一种元素组成的不同单质形态。在高中阶段,学习范围进一步扩大,还会接触到同位素的概念。
磷的所有同素异形体有哪些?磷的同素异形体包括: 白磷(黄磷),分子式为P4,呈四角锥形。 红磷,其结构由多分子不规则排列组成。 黑磷,具有金属光泽,目前已知的黑磷有斜方、菱形、立方和无定形四种结构。
磷有白磷、红磷 、黑磷3种同素异形体 。白磷又称黄磷,是白色至黄色的半透明固体,很软并像蜡,熔点为41℃ ,沸点280℃,密度82克/厘米3。白磷的性质不稳定 ,能自动地转变为稳定的红磷,常温下这种转变非常慢。白磷在空气中能被氧化为P4O10,温度超过40℃时能着火(自燃)。