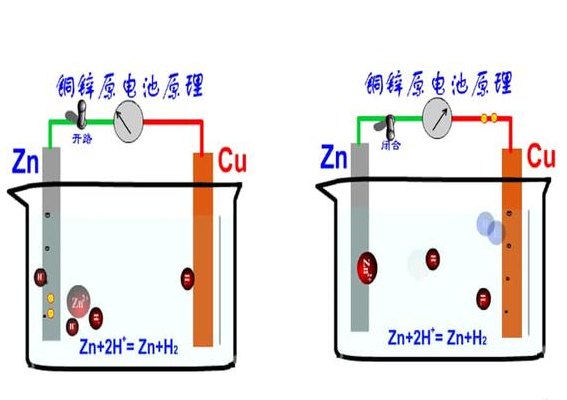
原电池原理(暖贴原电池原理)
简述原电池原理,及其应用举例
原电池原理是利用两个电极之间的化学反应,将化学能转化为电能。具体举例如下:原电池是一种通过化学反应将化学能转化为电能的装置。其原理是利用两个电极之间的化学反应,将化学能转化为电能。在原电池中,两个电极分别是正极和负极,它们之间通过电解质溶液相连。
原电池的原理及应用 铅蓄电池 铅蓄电池常用于汽车,很笨重,可充电。 干电池 Zn - Mn 电池 (干电池) 中央的炭棒是正极板,其周围有MnO2 , 锌皮是负极。两极间有 NH4Cl , ZnCl2 和淀粉,呈糊状 银锌电池 银锌电池 电子手表,计算器使用的纽扣电池是银锌电池 。
根据原电池装置中电流表的指针方向判断,指针指向的那一极为正极。
电芯-电池模组-电池Pack
锂电池模组是一个较为完整的系统,而PACK是单个组件。锂电池模组是由几颗到数百颗电池芯经由并联及串联所组成的多个PACK,除了机构设计部分,再加上电池管理系统和热管理系统就可组成一个较完整的锂电池包系统。PACK是包装、封装、装配的意思,其工序分为加工、组装、包装三大部分。PACK是单个组件。
电池Pack,电池模组,电芯形成一组概念。
电池PACK一般指的是组合电池,主要指锂电池组的加工组装,主要是将电芯,电池保护板,电池连接片,标签纸等通过电池PACK工艺组合加工成客户需要的产品。
原电池原理
原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。其中,活泼性较强的金属(通常是负极)会与电解质溶液中的阳离子发生氧化反应,释放电子并产生电流。
原电池:是利用两个电极的电势的不同,产生电势差,从而使电子流动,产生电流。需要注意的是,非氧化还原反应也可以设计成原电池。
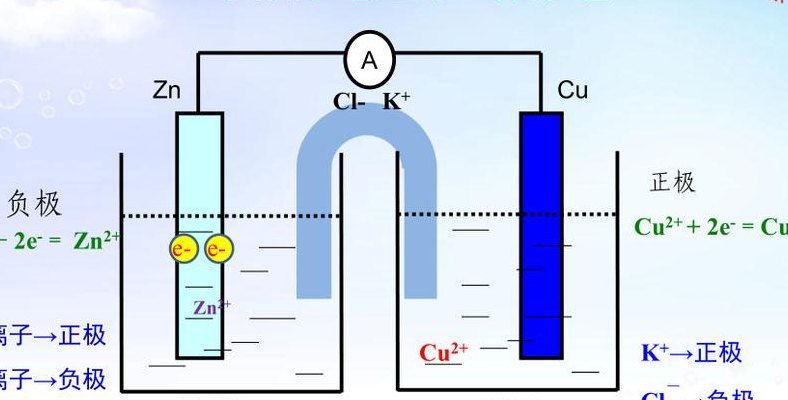
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。原电池的电极的判断:负极:电子流出的一极;发生氧化反应的一极;活泼性较强金属的一极。正极:电子流入的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极。
原电池的工作原理?
原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。其中,活泼性较强的金属(通常是负极)会与电解质溶液中的阳离子发生氧化反应,释放电子并产生电流。
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。原电池的电极的判断:负极:电子流出的一极;发生氧化反应的一极;活泼性较强金属的一极。正极:电子流入的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极。
原电池的工作原理是利用化学能转化为电能的装置,通过氧化还原反应将化学能转变为电能。氧化还原反应是原电池工作的基础。在原电池中,正极和负极之间通过电解质连接,形成了一个闭合回路。正极材料通常是具有高电势的金属或化合物,而负极材料则是具有低电势的金属或金属氧化物。
原电池的工作原理是通过化学反应产生电能。原电池的工作原理可以分解为以下要点:氧化还原反应产生电子流动。在原电池中,负极材料发生氧化反应,正极材料发生还原反应。这些反应导致电子从负极流向正极,形成电流。在此过程中,电解质帮助离子在溶液中移动,从而完成电路。能量转换。原电池的核心是能量转换过程。
原电池是一种利用化学能转化为电能的装置,其原理:化学能转化为电能、电子传递、氧化还原反应、电解质。化学能转化为电能:原电池的本质是将化学能转化为电能。在原电池中,化学反应将电子从负极传递到正极,从而产生电流。负极通常是较活泼的金属,正极则是较不活泼的金属。
原电池原理是什么?
原电池的原理包括:化学反应、电子转移、离子移动、电动势。化学反应:原电池的核心是化学反应。在原电池中,两种不同的金属(通常是活泼性不同的金属)被放置在电解质溶液中,并连接成一个闭合电路。其中,活泼性较强的金属(通常是负极)会与电解质溶液中的阳离子发生氧化反应,释放电子并产生电流。
原电池原理是:原电池是可以通过氧化还原反应而产生电流的装置,也可以说是把化学能转变成电能的装置。
原电池原理是通过氧化还原反应而产生电流,也可以说是将化学能转变成电能。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。例如铜锌原电池又称丹尼尔电池,其正极是铜极,浸在硫酸铜溶液中;负极是锌板,浸在硫酸锌溶液中。
原电池的工作原理如下:电极材料由两种金属活泼性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。电解质存在。两电极之间有导线连接,形成闭合回路。发生的反应是自发的氧化还原反应。只要具备前三个条件就可构成原电池。
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。原电池的电极的判断:负极:电子流出的一极;发生氧化反应的一极;活泼性较强金属的一极。正极:电子流入的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极。