点水成冰的原理(点水成冰的原理视频)
点水成冰是一个常见现象,其原理是什么?
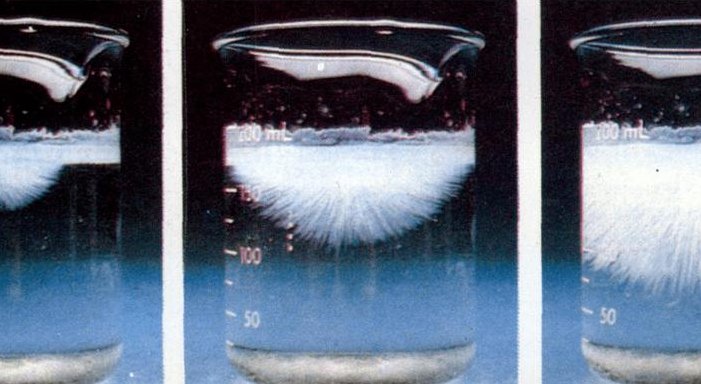
1、点水成冰的原理点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液或加入溶质的籽晶,即能析出过量溶质的结晶。
2、“点水成冰”是一个很神奇的现象,这个现象的发生需要环境的相对温度很低,而且在水的要求上也是有限制的。像我们经常饮用的纯净水其实很难做到点水成冰的,因为水在结冰的时候是需要一些杂质的,也就是所谓的结晶核,有了这个前提,在再结合温度的调整,做到点水成冰的现象是很容易的。
3、点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液即能析出过量溶质的结晶。注意事项:水有三态,固液气,也被称为三相。
4、点水成冰实验原理是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
5、点水成冰的原理实际上是过饱和溶液不稳定性的实验现象。将醋酸钠的热饱和溶液平静地冷却,通常不会发生结晶,这种溶液被称为过饱和溶液,它是一种介稳体系,即一种不稳定但能够暂时存在的体系。 当这种过饱和溶液被搅动或者加入小的“籽晶”时,超量的溶质就会结晶出来。
点水成冰是什么原理
1、点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液即能析出过量溶质的结晶。注意事项:水有三态,固液气,也被称为三相。
2、点水成冰实验原理是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
3、现点水成冰现象的出现是由于过饱和溶液因不稳定性而产生的。点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。
点水成冰实验原理
1、点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液即能析出过量溶质的结晶。注意事项:水有三态,固液气,也被称为三相。
2、点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
3、点水成冰的原理是:由于过饱和溶液因不稳定性而产生的。点水成冰的原理是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。
4、点水成冰实验原理是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
5、点水成冰的原理实际上是过饱和溶液不稳定性的实验现象。将醋酸钠的热饱和溶液平静地冷却,通常不会发生结晶,这种溶液被称为过饱和溶液,它是一种介稳体系,即一种不稳定但能够暂时存在的体系。 当这种过饱和溶液被搅动或者加入小的“籽晶”时,超量的溶质就会结晶出来。
真正的点水成冰是什么原理?
点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液即能析出过量溶质的结晶。注意事项:水有三态,固液气,也被称为三相。
点水成冰实验原理是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
现点水成冰现象的出现是由于过饱和溶液因不稳定性而产生的。点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。
点水成冰原理是什么?
点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。当搅动此溶液即能析出过量溶质的结晶。注意事项:水有三态,固液气,也被称为三相。
点水成冰实验原理是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。
现点水成冰现象的出现是由于过饱和溶液因不稳定性而产生的。点水成冰的出现是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。
点水成冰实验的原理是通过降低水的温度,使水分子逐渐失去动力,从而经历由液态向固态的相变过程。在实验中,通过添加异物如盐,可以降低水的凝固点,促进水分子之间的结合,加快结冰过程。这是因为异物的存在干扰了水分子的有序排列,破坏了水分子之间的吸引力。
原理:这是过饱和溶液不稳定性的实验。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系(不稳定体系,但尚能存在)。当搅动此溶液或加入溶质的“籽晶”,即能析出过量溶质的结晶。附:如用硝酸钠、硫酸钠晶体(NaSO4·10H2O)可进行同样的实验。
点水成冰的原理是:由于过饱和溶液因不稳定性而产生的。点水成冰的原理是由于过饱和溶液因不稳定性而产生的。醋酸钠的热饱和溶液在不受扰动下冷却,结晶作用往往不会发生。这种溶液称为过饱和溶液,是一种介稳体系,本身虽然是不稳定体系,但是尚能存在。