轨道杂化需要能量吗(轨道杂化的目的是为了什么)
杂化轨道的能量是高了还是低了
杂化轨道是不同能级的电子进行线性组合。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等又高于原来的能量较低的能级的能量而低于原来能量较高的能级的能量。例如sp杂化的能级高于s, 但低于p。
杂化本身是不会降低能量的,反而会升高能量,但是杂化轨道有效地提高了电子云的重叠,总体上来说降低了能量。如果在CO2中sp3杂化,产生4个杂化轨道,但只能与氧原子形成2个sigma键,就剩余两个单电子,反而提高了能量;sp杂化产生2个sp轨道形成sigma键,剩下两个p轨道上的单电子与氧形成pai键。
当电子从能量较低的能级跃迁至能量较高的能级进行杂化时,它们会形成新的杂化轨道。这些杂化轨道的能量介于原能级之间,既高于能量较低的能级,又低于能量较高的能级,这种平衡使得化学反应更为稳定。杂化轨道的形成遵循一个基本原则,即原子轨道最大重叠原理。
介于sp轨道之间,即比s轨道能量高比p能量低。
原子轨道杂化理论?
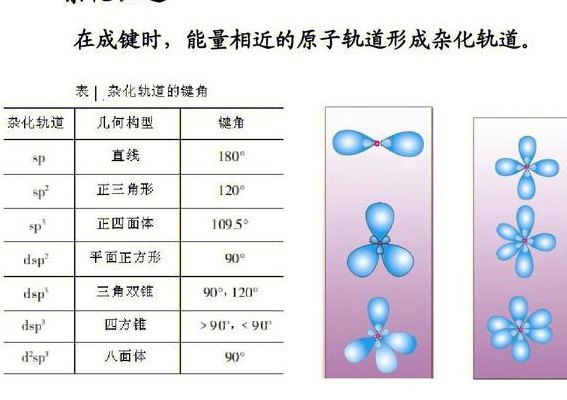
杂化理论认为: 杂化轨道不变,杂化轨道能量相同。如: 1个S轨道与1个P轨道杂化,生成1个SP杂化轨道,有个个轨道,此轨道能量相同,两轨道呈180^0 . 同理:1S+2P---1SP3 1S+2P---1SP杂化的目的就是使原子轨道能量最低,在空间中轨道之间斥力最小。
根据价层电子对互斥理论,中心原子价电子对数=σ 键数+孤电子对数,如果已知 σ 键数和孤电子对数,就可以逆向判断出中心原子价电子对数,从而判断出杂化方式。
(1)杂化轨道理论的基本要点:①能量相近的原子轨道才能参与杂化。②杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定。
根据配体:对于同一中心原子,不同配体产生的晶体场分裂能不同,当分裂能大于电子成对能时,配合物为内轨型,反之为外轨型。
杂化轨道理论(hybrid orbital theory)是1931年由Pauling L等人在价键理论的基础上提出, 它实质上仍属于现代价键理论, 但它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
形成杂化轨道有什么限制条件
1、①能量相近的原子轨道才能参与杂化。②杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定。③杂化轨道能量相同,成分相同,如:每个sp3杂化轨道占有1个s轨道、3个p轨道。
2、进行杂化的原子轨道的条件是能量相近的轨道。杂化概念:轨道杂化理论是指的原子轨道杂化理论。
3、杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定。不同类型的杂化轨道之间的夹角不同,成键后所形成的分子就具有不同的空间构型。~如果你认可我的请及时点击【采纳为满意回答】按钮~~手机提问者在客户端右上角评价点【满意】即可。
杂化轨道理论的基本要点是什么?
1、(1)杂化轨道理论的基本要点:①能量相近的原子轨道才能参与杂化。②杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定。
2、要点:在成键的过程中,由于原子间的相互影响,同一分子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化(Hybridization),杂化后形成的新轨道称为杂化轨道(Hybrid Orbital)。
3、要点 在成键的过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化,杂化后形成的新轨道称为杂化轨道。
4、不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化)又高于原来的能量较低的能级的能量而低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。杂化轨道成键时,要满足原子轨道最大重叠原理。
5、杂化轨道理论是化学键形成过程中一个关键概念,它描述了原子轨道如何重新组合以适应化学键的形成。当原子间的相互作用导致能量相近的轨道(如ns和np)发生线性组合,形成新的、数量相等的轨道,这种过程称为杂化。新生成的轨道被称为杂化轨道。杂化可以分为两种类型:等性杂化和不等性杂化。
原子轨道杂化要遵循哪些规则?
1、杂化后的轨道能量完全相同,形状也完全相同,只有伸展方向不同;杂化后的轨道只形成sigma键或孤电子对,不能形成pi键。
2、(1)杂化轨道理论的基本要点:①能量相近的原子轨道才能参与杂化。②杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定。
3、第二,分子轨道中电子的分布也和原子中的电子分布一样,遵循泡利不相容原理(最多一个分子轨道两个电子)、能量最低原理(按照排布之后能量要最低,大学会学到反键轨道知识等等,那时就知道为什么要能量最低)和洪特规则(一个轨道的电子要自旋相反,这和轨道的自旋量子数有关,结构化学中会学到)。
4、杂化轨道只能用于形成σ键。杂化后轨道数量不变,能量相同。杂化轨道只用于容纳形成σ键的电子或孤对电子,未参与杂化的轨道若有未成对电子用于形成π键。
5、sp2杂化:原子以一个ns和两个np轨道杂化,形成三个能量相同sp2杂化轨道,每个杂化轨道各含1/3s成分和2/3p成分。三个杂化轨道间的夹角为120度。判别 根据公式计算杂化类型。判断公式为k=m+n。当k=2,sp杂化;k=3,sp2杂化;k=4,sp3杂化。其中n值为ABn中的n,与中心原子结合的原子数。